研究内容RESEARCH
人工赤血球(人工酸素運搬体)の創製と臨床応用
日本の献血-輸血システムの安全性は世界最高水準にあり、国民の医療と健康福祉に多大の貢献をしています。しかし、感染の可能性や、保存期限が短く、災害や有事の危機管理体制に不安を残しています。また、患者さんの血液型を確認する作業があり緊急時の対応に課題があります。少子高齢化により血液の需給バランスが崩れつつあることも事実です。人工赤血球は、これらの問題を改善する新しい製剤としてその実現が期待されています。人工赤血球の研究は、期限切れ血液に最も多く含まれるヘモグロビン(Hb)の有効利用の観点から政策的に始まった経緯があります。期限切れ赤血球は、私たちが開発した精製/製造工程を経て、感染源を含まず、血液型が無く、長期保存に耐え、輸血治療を「補完」する人工赤血球製剤に「再生」されます(図1)。また、輸血では対応の出来ない疾患や外科的処置、Unmet Medical Needsへの対応も期待さています。化学教室では、日本発の革新的医薬品として人工赤血球の早期実用化を目指すことを目的とし、厚生労働科学研究費補助金、文科省科学研究費補助金、日本医療研究開発機構(AMED)委託研究費を受けて研究を進めています(研究代表者:酒井宏水)。また、本研究に派生する新しい研究(化学を基礎に、医学に貢献する研究)も開始しています。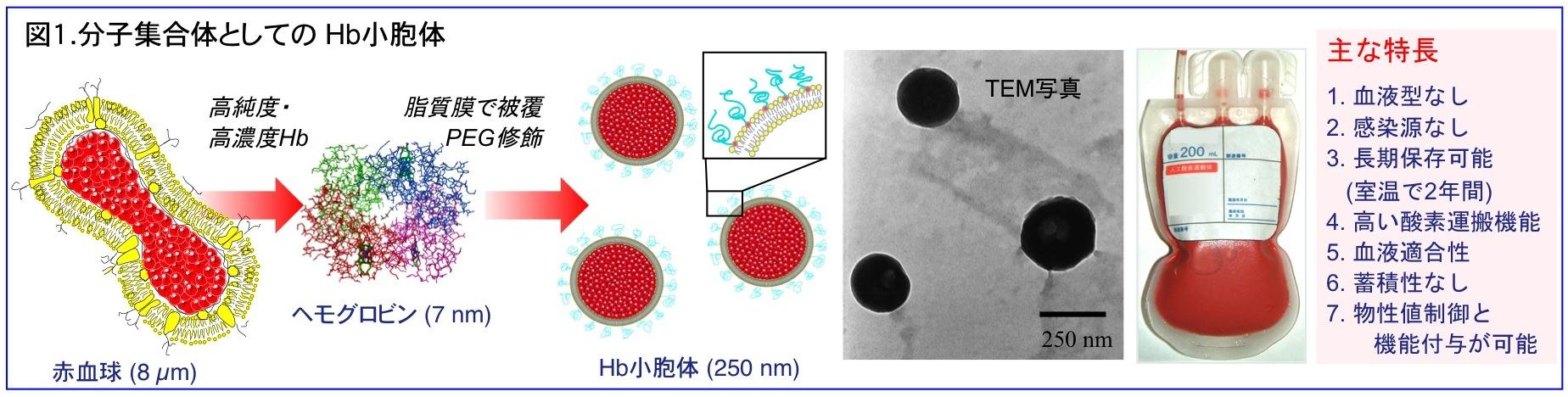
人工赤血球の調製法の確立(高分子化学を基礎とした展開)
人工赤血球(Hb小胞体)は、高濃度Hb溶液を脂質二分子層膜で被覆した、粒子径約250 nmの分子集合体です(図1参照)。分子集合体とは、分子間相互作用の働きで分子が自発的に集合形成した構造体のことを意味します。私たちは、高分子化学を基礎とし、主に早稲田大学酸素輸液プロジェクト(代表:故 土田英俊 早大名誉教授), 早稲田バイオサイエンスシンガポール研究所において、効率の高いHb精製法と高濃度Hbを脂質二分子膜で被覆する方法(混錬法)を考案しました。ウィルス不活化・除去は、Hbを一酸化炭素結合体(HbCO)とし、60℃の加熱処理とナノフィルトレーションを併用して完了させます。最終段階で光照射励起を利用したリガンド交換反応により、酸素結合体(HbO2)に容易に変換できます。Allosteric因子を共封入させて酸素親和度を制御します。ポリエチレングリコール(PEG)を結合した脂質を粒子表面に配置して小胞体粒子間の凝集抑制と分散安定度の向上を達成、さらに脱酸素化によりdeoxy-HbVが溶液のまま室温にて2年以上備蓄できることを確認しました。また、metHb(Fe3+)の非酵素的還元法を構築したほか、品質管理(無菌化)に必要なLPS検出LAL法も、LPSの両親媒性に起因する阻害作用を回避できる改良法を確立しました。これらの成果は、人工赤血球製造の根幹技術となっています。高いHb濃度、生体適合性、長期保存安定度は、他者の追随を許していません。
人工赤血球の輸血代替としての酸素輸送効果と安全性の実証
自作の人工赤血球の生体内における酸素運搬機能な安全性を実証するため、国内外の医学系、薬学系の研究者と共同研究を進めています。特に1996年から2年間、カリフォルニア大学サンディエゴ校バイオエンジニアリング部門 (指導教授:Marcos Intaglietta)に学振海外研究員として留学した際に、人工赤血球を投与した後の微小循環動態の計測(顕微鏡視野での局所O2濃度, 微小血管径と血流速度の計測)を重ね、動物投与試験と生体計測について学び、これを機に、各種モデル動物を用いた投与実験と生体計測を推進してきました。循環血液量の90%超過の交換(ラット)では、血圧、血液ガス組成、組織酸素分圧も正常値を推移しました(慶應義塾大学医学部 小林紘一 教授との共同)。微小循環動態観測では、修飾Hbの投与では血管内皮由来のNO捕捉による抵抗血管の収縮と同時に顕著な血圧亢進が観察されますが、Hb小胞体では血管収縮も血圧亢進もありません。出血性ショックの蘇生液としての投与では循環動態も血液ガス組成も脱血液の投与と同等に推移して全例が生存し、十分な酸素運搬機能が実証されました。体外循環、脳梗塞、皮弁創傷治癒、担がんモデルでも効能を確認しています。Hb小胞体は最終的に脾・肝など細網内皮系に移行し、貪食細胞に捕捉されたHb小胞体が7日以内に分解消失、また脾臓は一過性に肥大するものの7日で正常に戻り、血液生化学検査も異常を認めず、老化赤血球と同様の代謝経路をとるものと考えられました。反復投与試験としてラットにHb小胞体を14日間投与し、循環血液量の実に2.5倍もの量を投与しても体重は増加し続け、血液生化学的、組織病理学的検討でも顕著な副作用が無く、Hb小胞体の速やかな代謝を確認しました。造血細胞との共培養、脳内出血モデルの結果なども総合し、安全性の高い製剤であり、実用化を目指す研究を進めています(共同研究先一覧を参照)。得られた研究成果のほとんどは、学術誌に公表しています(研究業績を参照)。最近では、本製剤は輸血の代替としての利用のみならず、その物理化学的利点を活かし酸素治療薬として、虚血性疾患、臓器灌流液などへの利用、血管腫レーザー治療の標的としての利用、一酸化炭素(CO)キャリア治療薬(CO-HbV)として様々な炎症性疾患への利用、さらにはHbVのメト体(met-HbV)はシアン中毒解毒剤にも利用できることが動物実験から解り、本製剤の医療への貢献は当初予測していたものよりも大きくなるものと考えられます。

図2.(左)血管内を流れる人工赤血球の想像図、(中央)deoxy-HbVとCO-HbV、(右)奈良医大付属病院CPCにおける治験薬GMP製造
人工赤血球製剤のトランスレーショナルリサーチ
使われずに廃棄される献血血液を有効利用し、献血者の善意を無駄にしないこと、これが本製剤の研究開発の契機です。また現場医師からの本製剤に対する切実な思いが研究開発のDriving forceです。しかし、従来に無い範疇の製剤で、大量投与を前提とし、血液製剤(特定生物由来製剤)として開発のハードルが高く、日本は総じて危機管理意識が低く、他方、市場性が明確ではないとの見解で製薬企業との共同が困難な状況になっています。それでもなお研究目的が明瞭で、実用化されたときの医療への波及効果が絶大なものと期待されるので、アカデミアが主体になって研究開発を継続し、2015年からは日本医療研究開発機構(AMED)臨床研究・治験推進事業として支援を受け(第一期代表: 酒井宏水)、輸血の代替物としてHbVの安全性・有効性について先見的研究を継続するとともに、医薬品医療機器総合機構(PMDA)の薬事戦略面談を重ね、治験薬製造工程を確立するとともに、膨大なGLP非臨床安全性試験を順次進めました。そして、健常男性を被験者とする治験(Phase I, First-in-human: FIH)を実施するためAMED革新的医療シーズ実用化研究事業(第二期代表: 東 寛)が2018年度から始まりました(jRCT2011200004)。
その概要について触れますと、奈良医大附属病院の移植細胞培養センター(CPC)で治験薬GMP製造することについて2019年に学内了承を得て、体制を整えCPCの改造と機器類の導入、サニテーションを進めました。並行して管理文書およびSOPの整備を実施しました。この立ち上げにあたっては、旭川医科大学臨床研究支援センター及び北海道大学病院臨床研究開発センターの指導を得ました。原料となる精製Hbおよび脂質類の製造法を委託企業に技術導入し、製造体制を整えました。原料および治験薬の品質管理項目(Hb濃度、脂質濃度、粒子径、エンドトキシン、無菌性など)について、外部検査機関に測定法を技術導入しバリデーションを経て、品質管理体制を構築しました。製造スタッフの教育訓練の後、2020年より治験薬NMU-HbV製造のコールドラン2バッチ分を実施し、次いで本製造を5バッチ分行い、品質確認の後、製造物を治験薬として出荷しました。
旭川医科大学臨床研究支援センター及び北海道大学病院臨床研究開発センターを橋渡し支援拠点とし、両施設のARO機能を活用しました。2019年度早期にGLP非臨床試験が終了したことを受け、FIHプロトコルについてPMDA RS戦略相談での合意と、治験実施施設である北大の倫理委員会の承認を得て、2020年10月からFIHが開始されました。被験者は健康成人男性とし、NMU-HbVの投与量はコホート#1, #2, #3でそれぞれ10 mL, 50 mL, 100 mLとしました。FIHの結果、重篤な有害事象を認めた例はありませんでした。いわゆるinfusion reactionや発熱反応が散見されましたが、いずれも自然軽快しました。血液生化学検査・バイタルサイン・心電図・血圧の他覚的所見に関しては、臨床的に問題とすべき変動を認めませんでした。100 mLの投与をしたコホート#3において、2時間後の血漿中Hb濃度は0.28-0.3 g/dLで、半減期は8-9時間と推定されました。血中滞留時間は投与量依存性があることが非臨床試験から解っており、今後の臨床試験において実際的な投与量に増大した場合には、半減期は延長されるものと考えられます(Phase Iの結果については、Blood Advances誌に2022年に掲載済み)。
これらの成果を踏まえて、2021年度からはAMED橋渡し研究プログラムシーズB (第三期代表: 酒井宏水)が開始され、Phase Ib, Phase IIの実施に向け準備を進めました。女性を被験者に加えるため、追加で必要となるGLP非臨床毒性試験を進めるとともに、PMDA RS対面助言を経て、Phase 1bのプロトコルが決定されました。Phase IIについては、本製剤は酸素運搬機能があるのみで止血機能は無いことから、止血手技が完了し比較的安定した貧血状態における投与から開始することを想定し、研究班で議論を進めました。そして、Phase Ib試験をアカデミア主体で進めるプロジェクトが2024年度AMED橋渡し研究プログラムシーズC (第四期 代表: 松本雅則)としてスタートしました。治験薬GMP製造と治験を奈良医大で実施する画期的な内容であり、今後も実用化に向け研究開発を着実に進めてまいります。
わが国における人工血液の研究
1997年から厚生科学研究費補助金(高度先端医療研究事業)として「人工血液」の研究が推進されるようになり、現在に至っています。また、わが国では薬害問題や阪神淡路大震災の経験から、血液製剤の安定供給を目指す方針が掲げられ、2002年 改正薬事法:衆議院厚生労働委員会決議 (医薬品・医療機器の安全対策推進に関する件)には、「五. 人工血液についてはその有効性及び安全性が確保されたものの製品化が促進されるよう、研究開発の促進をはかること。」が記載され、国策として推進されるようになりました。内閣の骨太方針2023には、本製剤に関連し「献血への理解を深めるとともに、血液製剤の国内自給、安定的な確保及び適正な使用の推進を図る」が盛り込まれ、本製剤の開発の重要度が更に高まっています。
実は既に1980年代、日本赤十字社が「期限切れ赤血球の有効利用」の観点から人工赤血球(修飾Hbなど)の開発を開始した経緯があります。現在では供給体制の整備(集約化)や、保存期間の延長(3週間から4週間)で、統計上は期限切れが減少しており、人工赤血球の原料が減少していると言えます。他方、期限切れは潜在的にもっとあると言われており、医療機関で発生する期限切れ赤血球すべてを、一カ所に効率よく回収するシステムの構築が必要と考えます。また、採血量過不足、不規則抗体の献血液や、ALT検査不合格の献血液なども多くあると言われています。輸血が行われている以上、廃棄血は必ず生じるものであり、その有効利用は重要な課題として残ります。ヘモグロビン精製工程では、60℃での加熱による徹底したウィルス不活化とナノフィルトレーションによるウィルス除去工程を採用しており、血液の成分の中で最も沢山あるタンパク質ヘモグロビンは、安全な原料として再生が可能です。他方、組換えヘモグロビンを使用すれば、原料の問題は克服できます。事実、米国では、B社が組換えヘモグロビン(変異型)を開発しました。遺伝子組換えヘモグロビン小胞体の調製は技術的には可能です。しかし、投与量が一般の遺伝子組み換え製剤に比較して大量になることから、製造費用の点で課題が残ります。家畜由来のヘモグロビンを使う方法も検討されています。ブタやウシのヘモグロビンであれば供給には問題ありません。これらヘモグロビンから調製した人工赤血球も、ヒトヘモグロビンから調製したものと比較して同等に機能することが確認されています。
血液成分(赤血球、血小板、白血球、抗体、血漿蛋白など)の代替物の物性、製造、動物試験の方法や成績評価、臨床試験に向けたガイドラインやプロトコール、成績評価などの研究や討議をする学会として、1993年に日本血液代替物学会が設立され、2023年には第30回の記念シンポジウムが開催されました。人工血液、人工赤血球の開発は一般の医薬品開発には無いいくつかの課題を含んでおり、一企業が単独で達成できる事ではありません。日本血液代替物学会をはじめとする関連学会、厚生労働省、日本赤十字社、AMED、PMDA、その他関連機関と綿密に協議し、また協力を得ながら、人類の健康福祉の増進の役割を担う、意義のある本研究を進めていきたいと考えています。
バナースペース
酒井研究室
〒634-0813
奈良県橿原市四条町88
TEL 0744-22-3051(代表)